Quinta-feira, 20 de novembro de 2025
Quinta-feira, 20 de novembro de 2025
Por Redação O Sul | 31 de janeiro de 2021
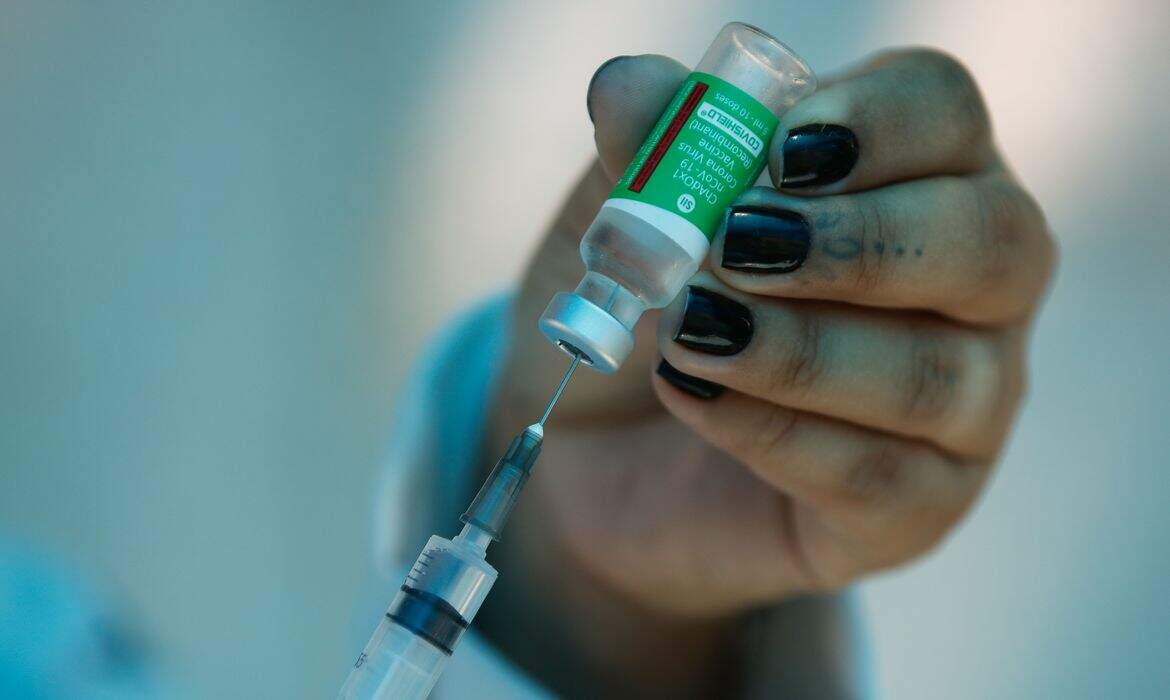
A Fiocruz pediu à Agência Nacional de Vigilância Sanitária (Anvisa) o registro definitivo da vacina contra o coronavírus fabricada pela farmacêutica AstraZeneca em parceria com a Universidade de Oxford. Em caso de aprovação, algumas mudanças no uso do imunizante ocorrem. Por exemplo, ele poderá ser aplicado em massa e comercializado, inclusive com as clínicas de vacinação privadas.
Segundo Gustavo Mendes, gerente geral de medicamentos e produtos biológicos da Anvisa, para conseguir o registro definitivo é preciso entregar uma série de informações robustas que comprovem a segurança e eficácia da vacina, respondendo qualquer questionamento que tenha ficado em aberto no processo de uso emergencial. Estas respostas dão embasamento para a liberação da vacinação em massa dentro do que é estipulado na bula.
“O registro emergencial é uma autorização temporária que requer um acompanhamento muito próximo desta vacina e é focado em populações específicas. Para o registro (definitivo) é preciso ter respostas mais concretas, informações que tornem permanente a decisão de disponibilizar a vacina para uso em massa e para comercialização, já que o registro vale por 10 anos”, diz Gustavo.
Apesar de o registro definitivo possibilitar a ampliação do público que pode ser vacinado, a aplicação das doses deve seguir à risca o que a bula recomenda. Por exemplo, se não for indicado vacinar menores de idade, esse grupo não poderá ter acesso à vacina.
Após o registro definitivo, a vacina pode ser livremente comercializada no Brasil pela instituição responsável por ela no país — no caso do imunizante AstraZeneca/Oxford é a Fiocruz. As doses podem ser vendidas, inclusive, para as clínicas de vacinação privadas.
O registro definitivo emitido pela Anvisa dá uma garantia a mais de que a vacina é segura e eficaz para prevenir a doença para a qual ela é designada — neste momento, contra a Covid-19. Isto porque a liberação só ocorre quando 100% das dúvidas são sanadas.
Mendes explica que o uso emergencial de vacinas não existia na Anvisa antes da pandemia de Covid-19 e foi criado, alinhado a outras agências reguladoras internacionais, com o objetivo de disponibilizar as vacinas o mais rapidamente possível, sobretudo para os grupos mais vulneráveis. Isto ocorreu porque, mesmo não tendo estudos finalizados de eficácia ou com algumas incertezas sobre o público-alvo, entendia-se (com base na orientação da Organização Mundial da Saúde) que as vacinas que apresentassem pelo menos 50% de eficácia já teriam um grande ganho para a saúde pública. Por isso, seria interessante disponibilizar a vacina e observar se a eficácia seria suficiente. Mas, para conseguir a autorização de uso emergencial é necessário apresentar também uma série de informações que demonstrem que o imunizante é seguro.
De acordo com Mendes, quando uma empresa pede o uso emergencial de uma vacina à Anvisa, um de seus compromissos é solicitar o registro definitivo, apresentando todas as informações que esclareçam possíveis incertezas surgidas durante o uso emergencial. “A autorização de uso emergencial é como se fosse um pré-registro”, explica.