Saúde A Agência Nacional de Vigilância Sanitária aprovou um teste rápido para o coronavírus
Por Redação O Sul | 3 de junho de 2020
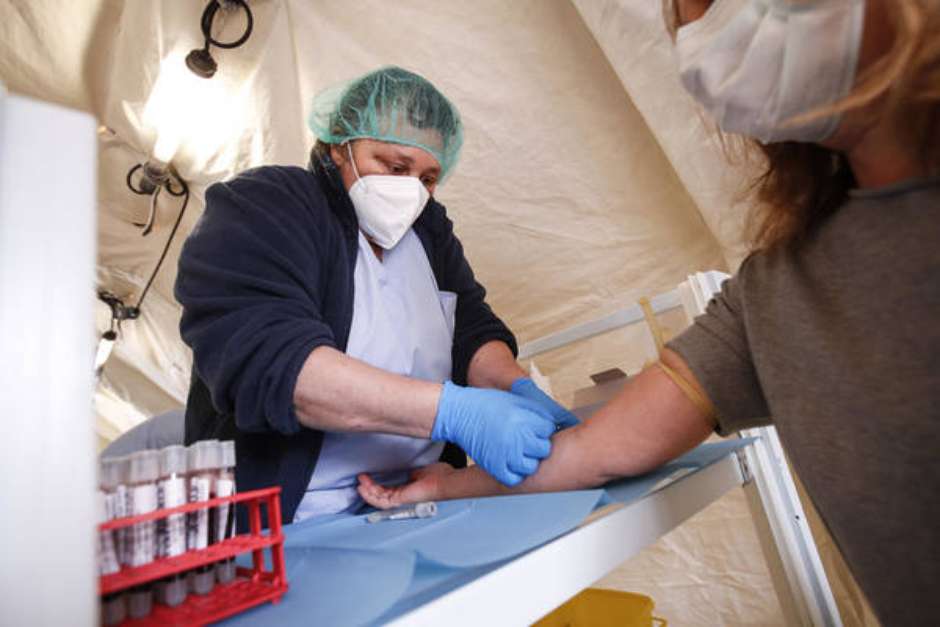
A Anvisa (Agência Nacional de Vigilância Sanitária) aprovou um teste rápido para o coronavírus Sars-CoV-2 desenvolvido pela empresa italiana DiaSorin. Em comunicado ao mercado divulgado nesta quarta-feira (3), a companhia farmacêutica, que é cotada na Bolsa de Valores de Milão, disse que a autorização foi concedida no último dia 25 de maio.
O teste sorológico tem o nome comercial de Liaison Sars-CoV-2 S1/S2 IgG e detecta a presença de anticorpos IgG desenvolvidos por pessoas já infectadas pelo novo coronavírus.
Segundo a DiaSorin, o exame tem “97,4% de sensibilidade” (percentual de acerto de positivos) e “98,5% de especificidade” (percentual de acerto de negativos). O resultado demora 35 minutos para sair.
“Estou profundamente convencido de que nosso teste vai ajudar no diagnóstico da Covid-19 e a avaliar o estado imunológico do paciente infectado, fornecendo indicações da presença de anticorpos IgG entre a população brasileira”, disse o vice-presidente de vendas da DiaSorin, Fernando Davico.
Potencial vacina
A Anvisa publicou na terça-feira (2), em edição extra do Diário Oficial da União, a autorização para realização de um estudo clínico no Brasil para testar uma potencial vacina desenvolvida pela Universidade de Oxford, no Reino Unido, para prevenir a Covid-19. O pedido de autorização foi feito pela empresa Astrazeneca do Brasil Ltda., que submeteu os dados e as informações sobre a vacina para avaliação da Agência.
Trata-se de um estudo controlado randomizado de fase III para determinar a segurança, a eficácia e a imunogenicidade da vacina ChAdOx1 nCoV-19 não replicante. Os estudos iniciais não clínicos em animais e os estudos clínicos de fase 1 em humanos para avaliar a segurança da vacina foram realizados na Inglaterra e os resultados demonstraram que o seu perfil de segurança foi aceitável.
A vacina ChAdOx1 nCoV-19, conhecida como AZD1222, usa um vetor viral baseado em uma versão enfraquecida do resfriado comum (adenovírus) contendo o material genético da proteína spike Sars-CoV-2. O vetor de adenovírus recombinante (ChAdOx1) foi escolhido para gerar uma forte resposta imune a partir de uma dose única sem causar uma infecção contínua no indivíduo vacinado.
Desde o reconhecimento de calamidade pública no Brasil em virtude da pandemia do novo coronavírus, a Anvisa tem adotado estratégias para dar celeridade às análises e às decisões sobre qualquer demanda que tenha como objetivo o enfrentamento da Covid-19. Uma dessas estratégias foi a criação, no âmbito da Gerência Geral de Medicamentos (GGMED), de um comitê de avaliação de estudos clínicos, registros e mudanças pós-registros de medicamentos para prevenção ou tratamento da Covid-19 e para mitigação do risco de desabastecimento de medicamentos com impacto para a saúde pública devido à pandemia. As informações são da agência de notícias Ansa e da Anvisa.