Quinta-feira, 03 de julho de 2025
Quinta-feira, 03 de julho de 2025
Por Redação O Sul | 30 de dezembro de 2020
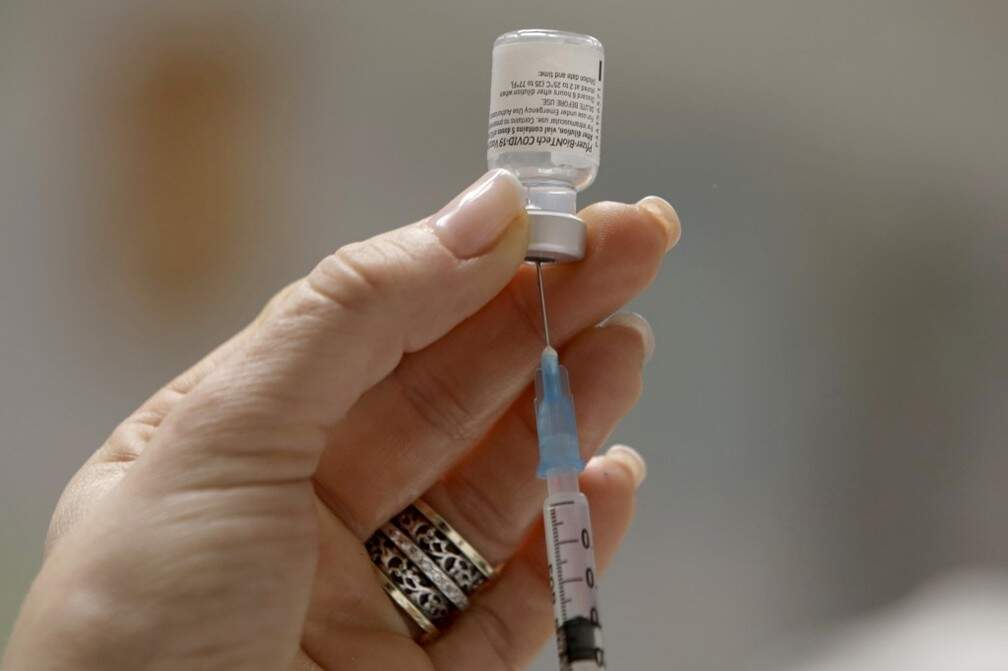
Alterações nas diretrizes ocorrem um dia depois de a Pfizer dizer que a agência brasileira pede "análises específicas" diferentemente de outros países
Foto: ReproduçãoA Anvisa (Agência Nacional de Vigilância Sanitária) atualizou nesta terça-feira (29) as diretrizes para a análise e aprovação do uso emergencial de vacinas contra o novo coronavírus. Entre as mudanças, está o fim da necessidade de o laboratório informar um cronograma de disponibilização das doses ao país.
Essas alterações vêm um dia depois de o laboratório Pfizer – que produz uma vacina contra a Covid-19 com 95% de eficácia já distribuído na União Europeia, nos Estados Unidos e outros países – sinalizar a desistência em pedir à Anvisa a autorização do uso emergencial do imunizante no Brasil.
O laboratório entendia que as diretrizes da agência levariam mais tempo para serem atendidas e, portanto, seria melhor para empresa trabalhar pela aprovação do registro definitivo, e não do uso emergencial – o que demora mais.
Em nota, a Anvisa diz que atualizou as diretrizes para “facilitar o entendimento do processo de envio de documentos, bem como tornar o procedimento mais ágil”. A agência não mencionou nenhum laboratório, no comunicado.
Pfizer quer registro definitivo
A Pfizer no Brasil sugeriu na segunda que dará prioridade ao registro definitivo da vacina contra o coronavírus. Isso porque empresa alega, segundo comunicado, que “as condições estabelecidas pela agência requerem análises específicas para o Brasil, o que leva mais tempo de preparação”. Entre esses requisitos, estão a necessidade de apresentar detalhes do quantitativo de doses e cronograma.
Para o laboratório, as condições da Anvisa só poderiam ser atendidas com uma análise mais longa – portanto, faria mais sentido à Pfizer proceder com o pedido da submissão contínua – ou seja, o registro definitivo com uma entrega de documentos ao longo do tempo para facilitar a análise –, que demora mais.
A empresa informou também que “já submeteu à agência, pelo processo de submissão contínua, os resultados da Fase 3 dos estudos, o que significa mais um passo rumo à aprovação da vacina”.